Bei Schulungen kommt es immer wieder zu Diskussionen, zum Beispiel über sichtbares blankes Kupfer an den Enden von Bauteilanschlüssen. Auch das Löten von Leiterplatten mit OSP-Finish (*), bei denen das blanke Kupfer teilweise noch sichtbar ist, führt häufiger zu Kommentaren. Aussagen wie sowas kann auf Dauer nicht mehr zuverlässig funktionieren.
Aber sind solche Kommentare berechtigt? Woher kommt diese Angst vor blankem Kupfer in elektronischen Produkten?
Dies kann zum Teil auf den alten MIL-2000-Standard zurückzuführen sein, der vorsah, dass kein blankes Kupfer sichtbar sein sollte. Wenn man also aus der Zeit stammt, als dies noch gültig war, wurde möglicherweise eingeprägt, dass man jederzeit sicherstellen musste, dass alle Enden der Bauteilanschlüsse mit Lötzinn bedeckt sein sollten. Also wurde nach dem Löten und Abschneiden der Anschlüsse der Lötkolben fleißig wieder zur Hand genommen und das Ende mit etwas Zinn versehen.
Heutzutage wird in den Standards IPC-A-610 und IPC/J-STD-001 für Lötverbindungen ausdrücklich darauf hingewiesen, dass sichtbares Kupfer an den Schnittenden von Bauteilen kein Ablehnungsgrund ist. Und es kann auch zu Pads/Lötaugen kommen, bei denen Teile noch nicht mit Lot bedeckt sind, wenn die Lötverbindung ansonsten den Anforderungen entspricht.

Kupfer sichtbar, aber Lötstelle entspricht den Anforderungen.
Und doch gibt es immer noch Mitarbeiter, die, wenn sie auch nur das kleinste Stück Kupfer auf ein Pad/Lötauge sehen, entschlossen zum Lötkolben greifen, um es unter einer Schicht Lötzinn zu „vergraben“. Manchmal sogar ohne sich dessen bewusst zu sein, dass sie dadurch die Verbindung tatsächlich verschlechtern. Das Argument, dass das freiliegende Kupfer oxidiert, ist sicherlich richtig. Es ist wichtig zu wissen, welchen Einfluss die entstehende Oxidschicht auf die Zuverlässigkeit des Produkts hat.
In diesem Zusammenhang ist es wichtig zu wissen, was Oxidation eigentlich bedeutet und dass man diese nicht mit Korrosion verwechseln darf. Erstens ist Oxidation ein Reaktionsprozess mit Sauerstoff (O2), Korrosion ist ein Prozess mit Sauerstoff und Wasser.
Die sich auf Kupferoberflächen bildende Oxidschicht sorgt dafür, dass keine Korrosion entstehen kann, diese Schicht versiegelt das darunter liegende Kupfer gegenüber der Umgebung und somit kann das darunter liegende Kupfer nicht mehr mit Sauerstoff in Kontakt kommen.

Leiterplatte mit OSP-Beschichtung (oben) und nachdem die OSP-Schicht abgebaut und das Kupfer oxidiert wurde (unten).
Die Oxidschicht schützt das darunter liegende Kupfer und behält diese Farbe über Jahre hinweg. Natürlich sind die unteren Pads nicht mehr lötbar.
Die Oxidation verläuft stufenweise, zunächst läuft folgende Reaktion ab: 4Cu+O2 führt zu 2Cu2O, wodurch eine rotbraune Oberfläche entsteht. Dann wird es schwarz, weil 2Cu2O + O2 in 4CuO zerfällt (dieser Prozess wird durch Hitze beschleunigt). Dann kommt es zur typischen Patinabildung von Kupferoberflächen (der grünen Farbe), die jedoch Jahre dauern kann.

Grüne Patina auf einer Kupferoberfläche
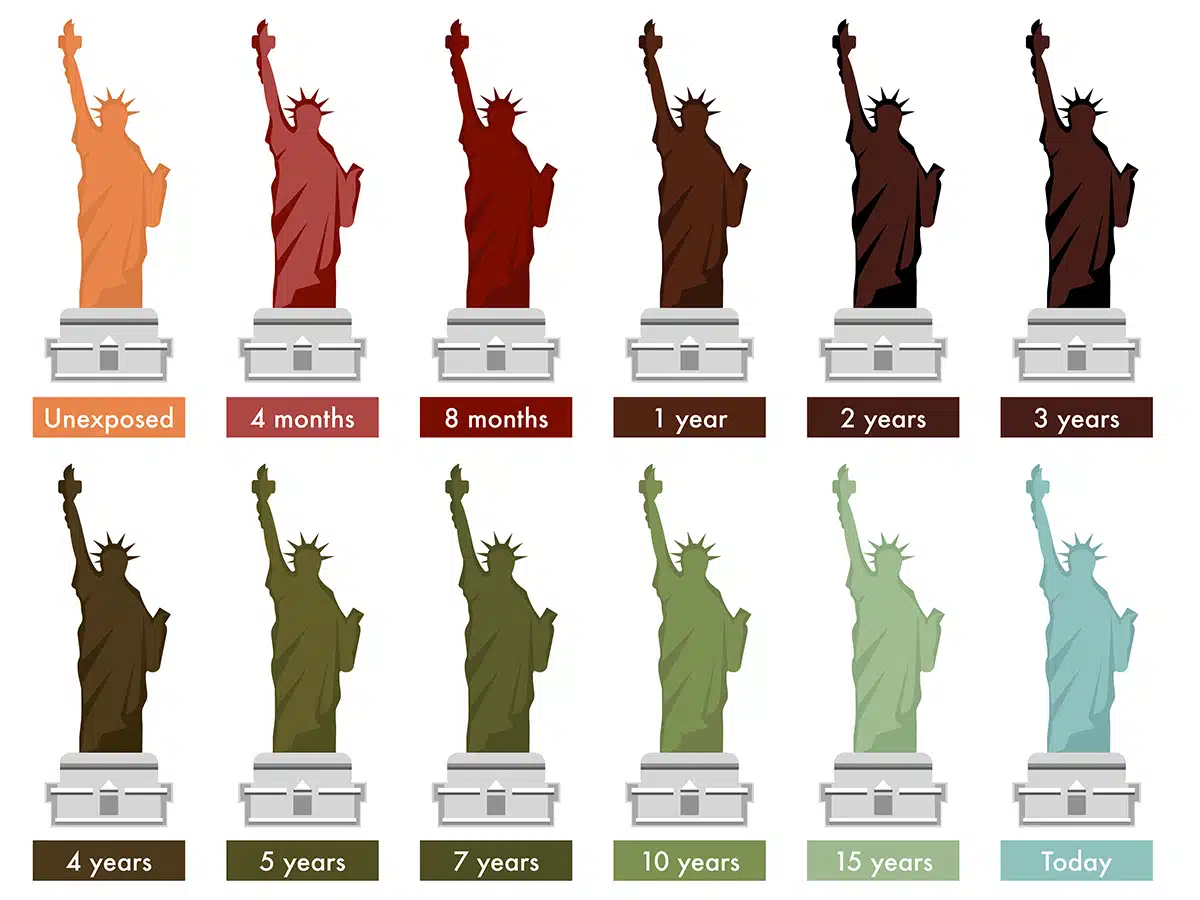
Jahrelang war beispielsweise die Freiheitsstatue in den USA kupferglänzend und rotbraun, bevor sie grün wurde. Wenn es regelmäßig mit Kupferglanz poliert worden wäre, würde es immer noch so glänzen wie im Jahr 1886.
Die Grünverfärbung hängt von verschiedenen Reaktionen ab, zum Beispiel hat Schwefel Einfluss auf die Endfarbe, aber auch CO, CO2 usw. Es können dann sogenannte Brochantit-, Malachit- oder Azurit-Reaktionen ablaufen. In allen Fällen verfärbt sich das Kupfer grün, Chemieexperten können sogar anhand der Farbe erkennen, welche Reaktionen stattgefunden haben. Es können beispielsweise Cu2CO3(OH), Cu3(CO3)(OH)2 oder Cu4So4(OH)6 entstehen, alle grün. Letzteres, auch Vitriol genannt, findet in den unterschiedlichsten Bereichen Anwendung, unter anderem in der Gesunderhaltung von Aquarienfischen. Aber auch andere Materialien können dafür verwendet werden, etwa einfache Holzkohle, die beispielsweise auch in Wassertanks verwendet wird, um die Wasserqualität optimal zu halten und Algenbildung vorzubeugen.
| Farben einiger Kupferverbindungen | |
| Cu | rot |
| Cu2O | rot bis dunkelgrau |
| FexCuyS | gold metallic |
| CuS | blau |
| Cu5FeS4 | goldbraun bis kupfer |
| Cu4SO4(OH)6 | grünes hydratisiertes Kupfer |
| Cu2Co3(OH)3 | grünes hydratisiertes Kupfer |
Die meisten Oxidationserscheinungen in Kupfer können durch eine Wasserstoffreaktion aufgehoben werden, d. h. wenn Sie das Produkt in eine wasserstoffreiche Umgebung bringen, erhält das Kupfer seinen Glanz zurück.
Verfahren, bei denen Oberflächen gezielt oxidiert werden, um das darunter liegende Metall zu schützen, sind beispielsweise das Eloxieren (wobei Aluminium elektrolytisch mit einer Oxidschicht auf der Oberfläche, Eloxal genannt) versehen wird, und das Verzinken z. B. von Dachrinnen, wobei das Zink an der Oberfläche oxidiert und sich so selbst opfert im Grunde liegt es am zugrunde liegenden Stahl.
Im Endeffekt kann es daher sein, dass die Verfärbung des freigelegten Kupfers in der Elektronik den Menschen nicht gefällt, dies wird sich jedoch nicht negativ auf die Funktion oder Lebensdauer auswirken.
(*) OSP steht für Organic Solderability Preservative (Organische Schutz Passivierung), eine organische, klare Beschichtung, die vom Leiterplattenlieferanten direkt auf das Kupfer der Pads/Lötaugen gesprüht wird und das Kupfer schützt.